Europäische Union – Das Rechtsetzungsverfahren
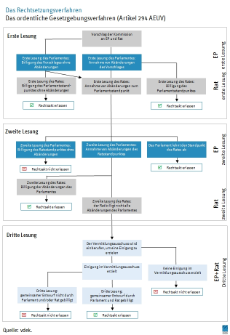
Die Grafik zeigt den Ablauf des ordentlichen Gesetzgebungsverfahrens nach Artikel 294 AEUV.

Hier finden Sie eine Übersicht über die wichtigsten gesundheitspolitischen Gesetzgebungsverfahren auf europäischer Ebene. Dazu zählen Verordnungen und Richtlinien der aktuellen zehnten Wahlperiode (seit 16. Juli 2024) sowie noch laufende Verfahren der vorherigen Wahlperioden.
» Hier gelangen Sie zu abgeschlossenen EU-Gesetzgebungsverfahren aus früheren Wahlperioden.

Die Grafik zeigt den Ablauf des ordentlichen Gesetzgebungsverfahrens nach Artikel 294 AEUV.
| Gesetz | Inhalt |
|---|---|
MDR-IVDR-Revision Inkrafttreten: Frühestens Ende 2026, eher später |
Ziel des Verordnungsvorschlags vom Dezember 2025 ist es, die Zertifizierungsverfahren für Medizinprodukte zu vereinfachen, administrative Belastungen zu reduzieren und den Marktzugang zu beschleunigen. |
Biotech-Act Inkrafttreten: Frühestens Ende 2026, eher später |
Ziel des Verordnungsvorschlags vom Dezember 2025 ist es, den Biotechnologie- und Bioproduktionssektor in der EU zu stärken und Europa als global wettbewerbsfähigen Biotech-Standort zu positionieren. |
Save Hearts Plan Inkrafttreten: Ein konkreter Zeitplan für die Umsetzung der Maßnahmen liegt noch nicht vor. Die gesetzlichen Regelungen des Pakets treten jeweils 20 Tage nach ihrer Verkündung in Kraft. |
Der Save Hearts Plan vom Dezember 2025 ist der erste umfassende Ansatz der EU zur Bewältigung von Herz-Kreislauf-Erkrankungen. Er sieht gezielte Maßnahmen zur Verbesserung von Prävention, Früherkennung und Behandlung dieser Erkrankungen vor. |
Digital-Omnibus Inkrafttreten: Die Teile des Digital-Omnibusses, die sich auf den AI-Act beziehen, sollen bereits bis August 2026 in Kraft sein. Andere Teile könnten später in Kraft treten. |
Ziel der Digital-Omnibuss-Verordnung vom November 2025 ist es, die EU-Vorschriften in den Bereichen KI, Daten und Cybersicherheit zu harmonisieren und zu vereinfachen. |
Critical Medicines Act
» DSV-Statement zum Critical Medicines Act - Berichtsentwurf Sokol (September 2025)
» AIM-Stellungnahme zum Critical Medicines Act (Juni 2025) |
Ziel des Verordnungsvorschlages von März 2025 ist es, die Verfügbarkeit, die Versorgung und die Produktion von kritischen Arzneimitteln innerhalb der EU zu verbessern. |
Revision des Arzneimittelrechts {COM(2023) 192 final}
Inkrafttreten: frühestens Sommer 2024
» AIM-Statement zur Trilogeinigung über die Arzneimittelreform (Dezember 2025)
» DSV-Statement zur Trilogeinigung über die Arzneimittelreform (Dezember 2025)
» Beitrag in ersatzkasse magazin. (4. Ausgabe 2024) zur Europäischen Arzneimittelreform
» DSV-Statement vom 22.01.2024 zur Europäischen Arzneimittelreform
» DSV-Kurzversion der Position vom 16.10.2023
» DSV-Position zur Verordnung vom 16.10.2023
|
Ende April 2023 hat die EU-Kommission einen Entwurf für die Revision des europäischen Arzneimittelrechts veröffentlicht. Mit der Reform werden vier Hauptziele verfolgt: (1) Gewährleistung des Zugangs der Patienten zu erschwinglichen Arzneimitteln und Deckung des unerfüllten medizinischen Bedarfs; (2) Förderung von Wettbewerbsfähigkeit, Innovation und Nachhaltigkeit der Arzneimittelindustrie in der EU und der Entwicklung hochwertiger, sicherer, wirksamer und umweltfreundlicherer Arzneimittel; (3) Verbesserung der Mechanismen der Krisenvorsorge und -reaktion und Inangriffnahme der Versorgungssicherheit; (4) Förderung hoher Qualitäts-, Wirksamkeits- und Sicherheitsstandards auf globaler Ebene.
» Position des Europäischen Parlaments (EP) zur Arzneimittelverordnung vom 10.04.2024
» Position des EP zur Arzneimittelrichtlinie vom 10.04.2024
» Verordnungsentwurf der EU-Kommission vom 26.04.2023
» Richtlinienentwurf der EU-Kommission vom 26.04.2023
» Summary Report: Arzneimittelstrategie für Europa vom 25.11.2020 |
Reform der Verordnung über die Koordinierung der sozialen Sicherheit COM(2016) 815: Vorschlag für eine Verordnung zur Änderung der Verordnung (EG) Nr. 883/2004 zur Koordinierung der Systeme der sozialen Sicherheit und der Verordnung (EG) Nr. 987/2009 zur Festlegung der Modalitäten für die Durchführung der Verordnung (EG) Nr. 883/2004
Inkrafttreten: am ersten Tag nach Veröffentlichung im Amtsblatt der Europäischen Union |
Der Reformvorschlag regelt neben neuen Arbeitslosen-, Pflege- und Familienleistungen den Zugang zu Sozialleistungen für nichterwerbstätige Personen sowie die soziale Sicherheit für entsandte Arbeitnehmer.
» EU-Verordnungsvorschlag über die Koordinierung der sozialen Sicherheit vom 13.12.2016 |

Ausgewählte Stellungnahmen und Positionen der AIM, der DSV und der ESIP unter Beteiligung des vdek zur EU-Gesundheitspolitik. » Lesen

Kurze Erläuterungen wichtiger Begriffe rund um die Europäische Union mit Fokus Politik und Gesundheit. » Lesen