Die Europäische Kommission (EU-Kommission) will das Medizinprodukterecht reformieren. Spätestens nach Skandalen um fehlerhafte Brustimplantate, instabilen Hüftgelenkersatz und undichte Lungenversiegelungssysteme ist dies dringend notwendig. Denn diese Produkte sind, anders als in den USA, auf dem europäischen Markt gelandet. Wie ist das möglich, was unterscheidet Europa von den sonst so liberalen USA und vor allem, was muss getan werden, um diese Gefahren zu beseitigen?
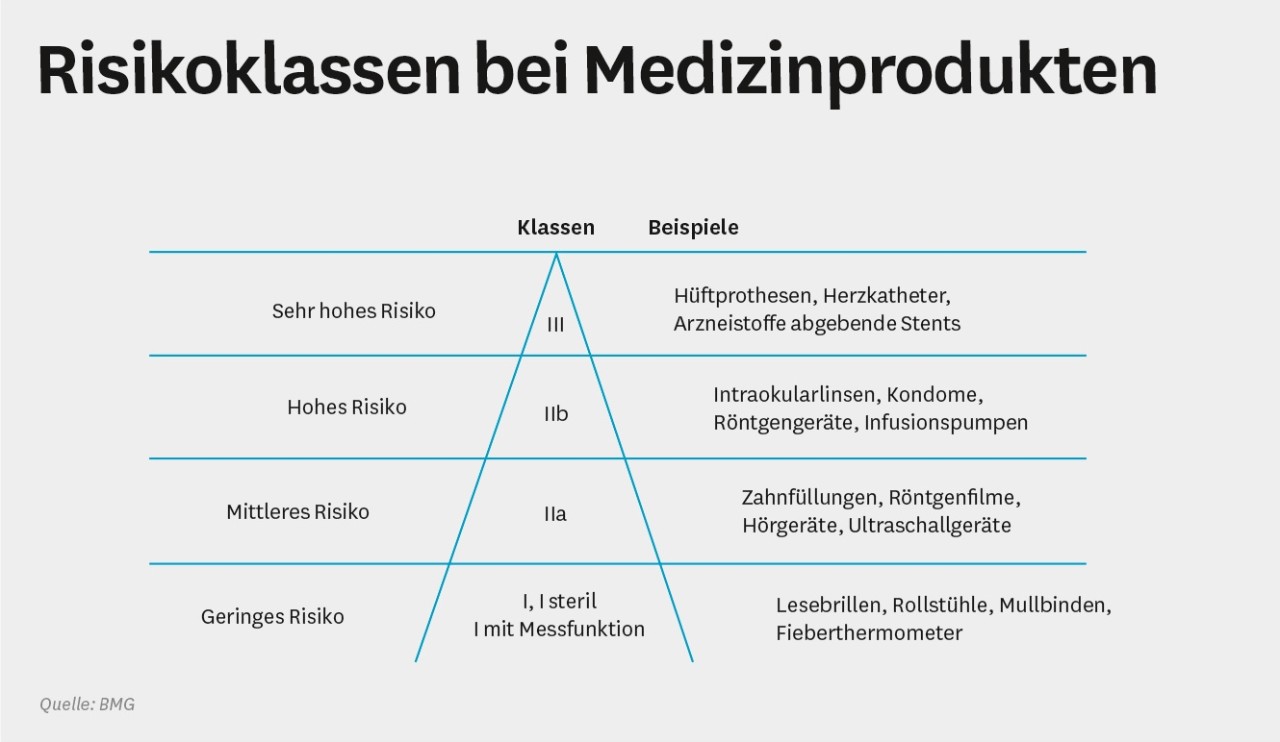
Für Medizinprodukte gibt es in Europa kein behördliches Zulassungsverfahren. Entwickelt ein Hersteller ein neues Medizinprodukt, so muss er es anhand von bestimmten Kriterien, die ihm eine EU-Richtlinie vorschreibt, selbst in eine von vier Gefahrenklassen einstufen. Dann beauftragt der Hersteller eine von rund 80 in der Europäischen Union (EU) bestehenden sogenannten benannten Stellen, die Sicherheit und die Funktionsfähigkeit des Produktes zu prüfen. Bei Bestätigung einer Übereinstimmung (Konformität) mit der Prüfnorm füllt der Hersteller selbst eine Konformitätserklärung aus und bringt das CE-Kennzeichen an sein Produkt an. Für die Marktzulassung ist es nicht notwendig, dass das Produkt auch einen patienten-relevanten Nutzen hat. Ebenso wenig müssen klinische Studien über Wirksamkeit und Nutzen vorgelegt werden. Dies ist lediglich bei Produkten der Gefahrenklasse III vorgesehen, kann aber auch hier vernachlässigt werden, wenn die Ähnlichkeit des Produktes mit einem auf dem Markt befindlichen Produkt belegt werden kann.
Dass der Hersteller selbst die benannte Stelle auswählt, macht das Prüfverfahren anfällig. Beanstandet eine benannte Stelle zu viele Mängel, muss sie damit rechnen, keine weiteren Aufträge von diesem Hersteller zu bekommen. Zwar sollen auf Basis der bestehenden EU-Richtlinie alle benannten Stellen in etwa ähnlich prüfen, aber der Versuch der britischen Medizinjournalistin Deborah Cohen zeigte, dass dies nicht der Fall ist. Ihr gelang es ohne große Mühe, eine Konformitätsbescheinigung für ein Produkt zu erhalten, das zuvor wegen Qualitätsmängel vom Markt genommen werden musste. In den USA dagegen prüft die Food and Drug Administration (FDA) zentral alle Produkte auf ihre Sicherheit. Hierfür müssen insbesondere bei Hochrisiko-Medizinprodukten der Klasse III auch klinische Studien vorgelegt werden, die den Nutzen darlegen. In den USA wurden Produkte nicht für den Markt zugelassen, die in Europa die Prüfung bestanden und sich später als Gesundheitsrisiko für den Patienten herausstellten. Dies waren unter anderem Silikonbrustimplantate, Ellenbogenimplantate, der Operationsroboter RoboDoc und Lungenversiegelungssysteme.
Pläne der EU-Kommission
Mit ihrem Vorschlag für eine neue Verordnung (VO) für Medizinprodukte versucht die EU-Kommission, das Recht zu harmonisieren. Bislang arbeiten die benannten Stellen nach 28 verschiedenen Rechtsordnungen. Die Zulassung von Medizinprodukten war bislang nur in einer Richtlinie geregelt und bedurfte der Umsetzung in nationales Recht. Insoweit ist dieser Vorschlag im Sinne der Einheitlichkeit zu unterstützen.
Darüber hinaus aber bleibt der VO-Entwurf weit hinter dem zurück, was in den USA gängige Praxis ist. Zwar sollen die benannten Stellen zukünftig strenger durch die Behörden des jeweiligen Mitgliedstaates geprüft werden. Auch die Prüfrechte und Pflichten gegenüber dem Her-steller und dessen Produktionsstellen werden deutlich gestärkt. Doch eine zentrale Zulassung, und sei es nur von Hochrisiko-Medizinprodukten der Klasse III, wird von der EU-Kommission nicht gefordert. Ebenso wenig will sie klinische Studien mit patientenrelevanten Endpunkten zwingend vorschreiben oder fordert gar eine Nutzenbewertung für Medizinprodukte sowie eine Veröffentlichungspflicht der entsprechenden Studien. Lediglich die Nachverfolgbarkeit von Produkten soll mittels einer Unique Device Identification (UDI) Number verbessert werden, um Produkte mit Sicherheitsrisiken leichter vom Markt zurückrufen zu können.
Große Hoffnung setzten die Interessenvertreter der Verbraucher und Patienten daher in das Europäische Parlament (EU-Parlament). Zusammen mit dem europäischen Dachverband Association Internationale de la Mutualité (AIM) hatten der Ersatzkassen- und andere Kassenartenverbände es zunächst erreicht, dass das EU-Parlament in Richtung US-amerikanisches Zulassungsmodell tendierte. Im Laufe des parlamentarischen Prozesses jedoch gelang es der Medizinprodukte-Industrie, wesentliche Punkte, etwa die zentrale Zulassung, wieder zu kippen bzw. so abzuschwächen, dass sie in der Praxis keine echten Verbesserungen mehr darstellen. Lediglich in der Frage der Haftung geht das EU-Parlament derzeit noch über den Vorschlag der EU-Kommission hinaus und fordert eine obligatorische Haftpflichtversicherung für alle Medizinprodukte.
Die Medizinprodukte-Industrie führte vor allem die Frage der Arbeitsplätze ins Feld. In Europa und insbesondere in Deutschland ist die Medizinprodukte-Industrie vornehmlich bei kleinen und mittelständischen Firmen angesiedelt. Diese fürchten, dass sie nicht die Kosten für ein zentrales Zulassungsverfahren mit hochwertigen Studien aufbringen können und somit gegenüber großen Unternehmen aus den USA benachteiligt sind. Tatsächlich ist das Zulassungsverfahren mit rund 240.000 US-Dollar in den USA gegenüber 80.000 Euro signifikant teurer als in Europa. Allerdings muss man wissen, dass nur zwei Prozent aller Medizinprodukte, wie von der AIM und dem Verband der Ersatzkassen e. V. (vdek) gefordert, den neuen Vorschriften unterliegen würden.
Des Weiteren argumentierte die Industrie mit dem Zugang der Patienten zu Innovationen. Auch hier scheinen ihr die Zahlen recht zu geben. Während in Europa das CE-Kennzeichen bereits nach durchschnittlich zwei Jahren vergeben wird, erhalten Hersteller in den USA das vergleichbare Prüfsiegel erst nach etwa drei Jahren und sechs Monaten. Nur sind Medizinprodukte in der Regel keine lebensrettenden Produkte. Vielmehr existieren bereits eine Vielzahl geprüfter und bewährter Behandlungsalternativen, sodass der Patient nicht auf unzuverlässige Scheininnovationen angewiesen ist.
Im parlamentarischen Verfahren liegt der VO-Entwurf nun zur Beratung im Europäischen Rat. Dieser muss mit dem EU-Parlament einen Konsens erreichen. Dabei muss dieser Konsens aber nicht zwischen dem Vorschlag der EU-Kommission und dem EU-Parlament liegen. Er kann auch darüber hinausgehen. Der vdek wird daher zusammen mit der AIM und den anderen Partnern in Europa in den kommenden Wochen versuchen, die Vertreter der Mitgliedstaaten im EU-Rat von der Notwendigkeit einer zentralen Zulassung von Medizinprodukten zu überzeugen. Dabei kommt insbesondere der AIM zu-gute, dass sie als Dachverband einflussreiche Mitglieder aus vielen europäischen Staaten hat. Mit einem greifbaren Ergebnis ist allerdings erst nach den Wahlen zum EU-Parlament Ende Mai 2014 zu rechnen.




 Gesunde Lebenswelten – Ein Angebot der Ersatzkassen
Gesunde Lebenswelten – Ein Angebot der Ersatzkassen Landesbasisfallwerte 2025
Landesbasisfallwerte 2025 ICF – Internationale Klassifikation der Funktionsfähigkeit, Behinderung und Gesundheit
ICF – Internationale Klassifikation der Funktionsfähigkeit, Behinderung und Gesundheit Beitragsbemessungsgrenzen und Beitragssätze 2025
Beitragsbemessungsgrenzen und Beitragssätze 2025 Heilmittelversorgung – Verträge und Vergütungen
Heilmittelversorgung – Verträge und Vergütungen


