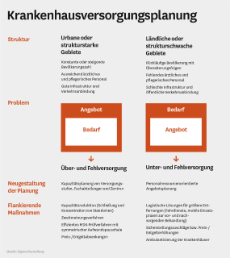
Die EU-Kommission will die Bewertung des therapeutischen Nutzens neu zugelassener Arzneimittel auf europäischer Ebene künftig vereinheitlichen. Dieser Vorstoß hat zum Teil weitreichende Auswirkungen auf das deutsche Gesundheitswesen. Eine kritische Betrachtung der Ziele und der mit dieser Regelung verbundenen Effekte auf das System der gesetzlichen Krankenversicherung (GKV).
Eines der wichtigsten Ziele in der Europäischen Union (EU) ist die Schaffung und Aufrechterhaltung eines freien und uneingeschränkten Warenverkehrs zwischen den Mitgliedsstaaten. Hierzu gehört auch schon lange die europaweite Versorgung mit Arzneimitteln. So ist es inzwischen fast der Regelfall, dass Arzneimittel mit neu entwickelten Arzneistoffen praktisch ausnahmslos durch die europäische Zulassungsbehörde, die European Medicines Agency (EMA), geprüft und für den Verkehr innerhalb der EU freigegeben werden.
Diese zentrale Zulassungsoption wird von fast allen Arzneimittelherstellern gerne genutzt, da sie innerhalb eines zeitlich straff organisierten Prozesses über eingereichte Zulassungsanträge entscheidet. Die dabei durchgeführte Nutzen-Risiko-Bewertung führt im positiven Fall dazu, dass mit Erteilung der Zulassung die grundsätzliche Option eröffnet wird, das betreffende Arzneimittel nahezu zeitgleich in allen EU-Mitgliedsstaaten zu vermarkten.
Dies gelingt jedoch nicht immer, da einige Staaten Hürden aufgebaut haben, die ergänzend zur immer notwendigen EMA-Zulassung auch eine vorherige Preisvereinbarung mit einem nationalen Institut erzwingt. Neben staatlichen Behörden wie Ministerien kommen hier auch wissenschaftliche Institutionen ins Spiel. Diese haben vorgeschaltet oder begleitend den konkreten therapeutischen Nutzen des neu zugelassenen Arzneimittels zu bewerten. Auf dessen Grundlage setzen dann die jeweiligen innerstaatlichen Erstattungsregelungen auf. Diese sogenannten Health Technology Assessments (HTA) werden evidenzbasiert von Institutionen wie dem britischen NICE, dem französischen HAS oder dem deutschen Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) bzw. dem Gemeinsamen Bundesausschuss (G-BA) unter Anwendung internationaler Standards zur Bewertung von medizinisch wissenschaftlichen Studien durchgeführt.
Auf Basis dieser Bewertung erfolgt eine jeweils national geprägte Abwägung des festgestellten Nutzens, zum Beispiel im Vergleich zu einer etablierten Vergleichstherapie und den Kosten, die hierfür akzeptabel erscheinen. Je nach Wirtschaftslage und Versorgungssituation konnte und kann dies bei dem gleichen Arzneimittel zu einer durchaus unterschiedlichen Erstattungspraxis in den einzelnen Ländern führen, die sich sowohl in Form von Leistungseinschränkungen als auch durch deutliche Preisunterschiede ausdrücken kann. Hierbei spielen natürlich auch sozio-kulturelle Unterschiede in den jeweiligen Nationalstaaten eine Rolle. Die damit verbundenen Effekte werden von den pharmazeutischen Herstellern als behindernder Eingriff in den freien Warenverkehr wahrgenommen, weshalb diese den Vorstoß der EU-Kommission von Anfang 2018 zur Vereinheitlichung vehement begrüßen. Schließlich sieht der Vorstoß vor, neben der zentralen europaweiten Zulassung nun auch die Bewertung des therapeutischen Nutzens in Bezug auf die entstehenden Kosten zu einem europaweit einheitlichen Prozess umzugestalten. Eher skeptisch bis ablehnend allerdings fielen hierzu die Reaktionen in vielen EU-Staaten aus, so auch in Deutschland oder Frankreich. Hierzulande waren und sind sich Politik und gemeinsame Selbstverwaltung in ihrer Ablehnung dieser Vorschläge weitgehend einig.
Ziele der EU-Kommission
Kurz zusammengefasst möchte die EU-Kommission mit diesem Vorschlag erreichen, dass alle Bürger der EU schneller und noch umfassender vom wissenschaftlichen Fortschritt profitieren können und sollen. Die verschiedenen nationalen Zugangsregelungen für neu entwickelte Arzneimittel oder Medizinprodukte werden dabei als eher hinderlich angesehen und sollen daher einem zentral organisierten Prozess weichen, der verbindliche Umsetzungen in allen EU-Mitgliedsstaaten erzwingt.
Deutschland ist bereits jetzt das Land, in dem neu zugelassene Arzneimittel am schnellsten in den Markt eingeführt werden. Trotz der mit dem Arzneimittelmarktneuordnungsgesetz (AMNOG) zum 1. Januar 2011 eingeführten frühen Nutzenbewertung durch den G-BA und die sich anschließenden Erstattungsbetragsverhandlungen zwischen GKV-Spitzenverband (GKV-SV) und Herstellern ist es nach wie vor aus Herstellersicht lukrativ, die Vermarktung neuer Arzneimittel in Deutschland schnellstmöglich nach Zulassung zu beginnen. Immerhin gibt es hier im ersten Jahr der Vermarktung eine vollkommen freie Preisbildung und einen uneingeschränkten Marktzugang für die gesamte Bevölkerung; also auch für die 90 Prozent der hierzulande gesetzlich Krankenversicherten, bei denen die Kosten unmittelbar von den gesetzlichen Krankenkassen getragen werden. Der Nutzenbewertungsprozess selbst ist strikt getaktet, wird für alle in Deutschland mit neuen Wirkstoffen in den Markt gebrachten Arzneimittel durchgeführt, dauert exakt ein Jahr und beinhaltet umfassende Beteiligungsrechte für die jeweiligen Hersteller. Das Verfahren ist zudem gerichtlich überprüfbar und es steht dem Hersteller frei, sein Präparat, beispielsweise bei fehlendem Zusatznutzen und damit drohendem massivem Preisverfall, auch kurzfristig wieder aus dem Markt zu nehmen.
Deutschland bleibt somit das, was es immer war, nämlich: das Referenzpreisland für Europa und große Teile der Welt. Mehr als 80 Staaten weltweit referenzieren auf den deutschen Marktpreis mit dem Ergebnis, dass die Präparate, zumindest solche mit einem teilweise attestierten Zusatznutzen, überall preiswerter sind als bei uns. Hinzu kommt, dass auch in Teilindikationen, für die kein Zusatznutzen attestiert werden konnte, in der Folge eine Verordnung zulasten de GKV grundsätzlich möglich bleibt. In vielen anderen Staaten ist oft nur ein selektiver Zugang für nur kleine Patientenklientele eröffnet, dieser ist zudem zeitlich befristet und lediglich über Krankenhäuser zugänglich. Vor diesem Hintergrund ist die in Deutschland verlautbarte Kritik verständlich. Denn hier muss im Vergleich zwischen der aktuellen Praxis und dem Vorhaben der EU von einer Verfahrens- und Versorgungsverschlechterung ausgegangen werden.
Mögliche Alternativen
Bereits jetzt arbeiten die in den einzelnen Mitgliedsstaaten aktiven HTA-Körperschaften wissenschaftlich eng zusammen. Sie tauschen sich über sowohl die angewendeten Methoden als auch die erzielten Ergebnisse aus. Dies könnte, wie bisher auch, durch die EU gefördert werden. EU-Staaten, die über keine HTA-Institution verfügen, könnten von den Ergebnissen profitieren, indem man sie an den Erkenntnissen teilhaben lässt. Selbst gemeinsame Expertisen unter EU-Aufsicht bzw. von der EU-Kommission beauftragt wären denkbar, sofern deren Nutzung nicht zwingend vorgeschrieben wird. So blieben die notwendigen Spielräume für nationale Entscheidungen erhalten, die sich auch weiterhin an der jeweiligen Infrastruktur und finanziellen Leistungsfähigkeit orientieren und auf sozio-kulturelle Besonderheiten Rücksicht nehmen können.










 Gesunde Lebenswelten – Ein Angebot der Ersatzkassen
Gesunde Lebenswelten – Ein Angebot der Ersatzkassen Landesbasisfallwerte 2026
Landesbasisfallwerte 2026 ICF – Internationale Klassifikation der Funktionsfähigkeit, Behinderung und Gesundheit
ICF – Internationale Klassifikation der Funktionsfähigkeit, Behinderung und Gesundheit Beitragsbemessungsgrenzen und Beitragssätze 2026
Beitragsbemessungsgrenzen und Beitragssätze 2026 Heilmittelversorgung – Verträge und Vergütungen
Heilmittelversorgung – Verträge und Vergütungen


