Mit der CAR-T-Zelltherapie – sogenannte Arzneimittel für neuartige Therapien – haben die Pharmaunternehmen Novartis und Gilead eine neuartige Krebsimmuntherapie entwickelt. Seit August 2018 sind die Präparate Kymriah® und Yescarta® in Deutschland für die Behandlung von austherapierten Patienten zugelassen, die an aggressiven Varianten von Leukämie und Lymphomen („Blutkrebs“) erkrankt sind. In den nächsten Jahren sind ähnliche Therapieverfahren zu erwarten, verbunden mit einem hohen Kostenanstieg für die gesetzliche Krankenversicherung (GKV).
Für die bisher im Rahmen der CAR-T-Zelltherapie zugelassenen Indikationen kommen etwa 1.400 bis 1.600 an Blutkrebs erkrankte Patienten pro Jahr infrage. Das Präparat wird nur einmal verabreicht, wobei die Heilungschancen der Betroffenen nach der heutigen Studienlage relativ hoch sein sollen. Die Kosten der reinen Zelltherapie liegen bei ca. 320.000 Euro ohne Mehrwertsteuer pro Patient. Hinzu kommen die Behandlungskosten. Diese können insbesondere bei häufig auftretenden Komplikationen sehr hoch sein. Beim Präparat Kymriah® handelt es sich um ein sogenanntes Blutpräparat, das heißt, dass die Mehrwertsteuer auf dieses Präparat entfällt. Ob auch das Präparat Yescarta® als Blutpräparat einzustufen ist, ist momentan noch in der Prüfung.
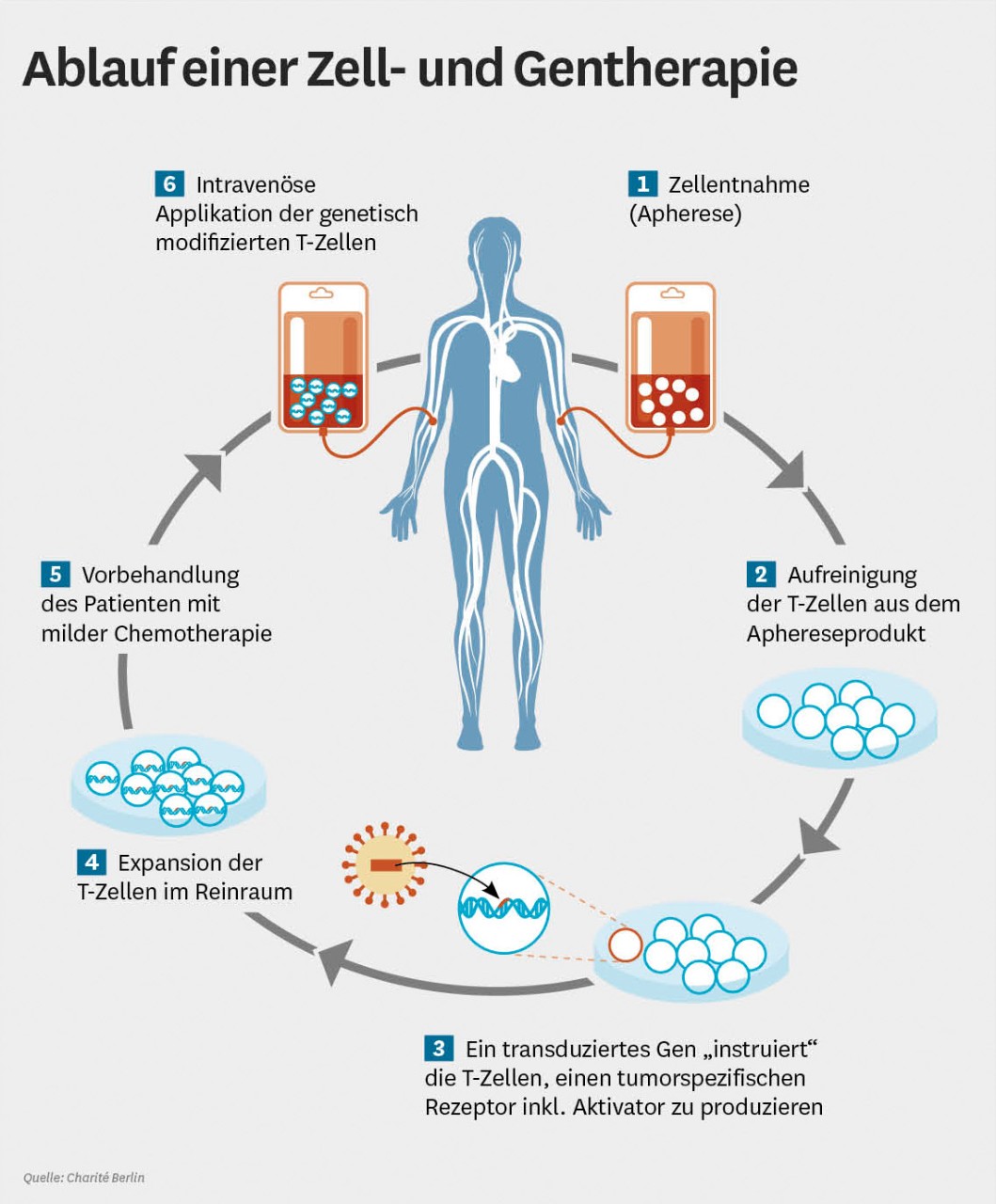
Wie funktioniert die Therapie?
Die CAR-T-Zelltherapie nutzt körpereigene T-Zellen („weiße Blutkörperchen“) des Patienten, um bestimmte Krebsarten zu bekämpfen. Dazu werden die weißen Blutkörperchen entnommen (Leukapherese) und im Labor gentechnisch so verändert, sodass sie sich später im Körper des Patienten an die Krebszellen binden und diese vernichten können. Aufgrund der häufig sehr schweren Nebenwirkungen, etwa einem Zytokinsturm – einer Überreaktion des Immunsystems, die vergleichbar mit einer schweren Sepsis ist – erfolgt die Verabreichung in der Regel im Krankenhaus. Hier ist oft eine intensivmedizinische Überwachung der Patienten erforderlich. Die CAR-T-Herstellung selbst erfolgt zurzeit ausschließlich in den USA.
Voraussetzungen zur Leistungsabrechnung
Über 160 Krankenhäuser haben bereits Anträge gestellt, um das hochinvasive Verfahren im Rahmen einer Regelung für „Neue Untersuchungs- und Behandlungsmethoden“ (NUB) zu erbringen. Diese Präparate verfügen nur über den sogenannten Status 4, die angefragten Methoden beziehungsweise Leistungen erfüllen also noch nicht die NUB-Kriterien. Dies bedeutet, dass derzeit keine Verpflichtung der GKV besteht, diese Leistungen im Rahmen von NUB-Vereinbarungen mit den Krankenhäusern zu vereinbaren.
Auch wenn die GKV vor diesem Hintergrund nicht zur Kostenübernahme verpflichtet und die Risikobehaftung der Präparate sehr hoch ist, ist es im Interesse der Versicherten, für eine optimale Versorgung in ausgewählten Unikliniken zu sorgen. Dies setzt voraus, dass diese Unikliniken weitergehende Qualitätsanforderungen erfüllen. Hierbei handelt es sich um eine Übergangsregelung, die endet, sobald die Präparate über den NUB-Status 1 verfügen, also die Methoden und Leistungen die Kriterien der NUB-Vereinbarung erfüllen, oder zwischen dem GKV-Spitzenverband und den Firmen Novartis und Gilead ein Erstattungsbetrag nach § 130b SGB V vereinbart wurde.
Es gibt zum Teil auch Unikliniken, die bereits angekündigt haben, die CAR-T selbst herstellen zu wollen. Diese Eigenherstellung ist im Preis günstiger als die oben genannten Präparate der Pharmafirmen. Allerdings werden hierzu auch teilweise patentrechtlich geschützte Viren von Pharmafirmen genutzt. Insgesamt dürfte es noch einige Zeit dauern, bis die noch offenen Fragen geklärt sind.
Qualitätssicherungsverfahren sind notwendig
Diese neue Gentherapie ist – wie alle neuen Verfahren auch – mit einem gewissen nicht kalkulierbaren Risiko für die Patienten verbunden. Daher kommen der Einhaltung von diversen Prozess- und Strukturkriterien und der Beteiligung an Qualitätssicherungsverfahren sowie einer Beteiligung an einem entsprechenden Register eine hohe Bedeutung zu. Deshalb ist eine Richtlinie beim Gemeinsamen Bundesausschuss (G-BA) für diese Form der Therapien unumgänglich. Dies setzt auch voraus, dass der G-BA mehr Durchgriffsrechte bei den Methoden und Arzneimitteln mit nicht ausreichend nachgewiesener Evidenz für die Qualitätssicherung, Regulierung und die Nachüberwachung dieser neuen Präparate erhält.
Ausblick
Aufgrund der starken Forschungsaktivitäten werden in den nächsten Jahren weitere Präparate für andere Indikationen auf den Markt kommen; es sind ähnliche Verfahren für solide Tumore zu erwarten. Das IGES Institut geht davon aus, dass in den nächsten Jahren 42 weitere Therapien auf den Markt kommen werden, die zum Teil mehrere Millionen Euro pro Behandlung kosten könnten. Angesichts dessen ist mit einem hohen Kostenanstieg für die GKV zu rechnen.
Zurzeit werden die Kosten für diese Einmaltherapie nicht im morbiditätsorientierten Risikostrukturausgleich (Morbi-RSA) abgebildet, was zu einer hohen finanziellen Belastung bei den betroffenen Krankenkassen führt. Hier ist der Gesetzgeber gefragt, dafür Sorge zu tragen, dass der medizinische Fortschritt langfristig bezahlbar bleibt. Auch nach Auffassung des IGES Instituts ist neben einer Berücksichtigung im Morbi-RSA eine Anpassung im Erstattungs- und Finanzierungssystem der GKV notwendig. Nicht nachvollziehbar ist, dass Pharmakonzerne im ersten Jahr willkürliche Preise für Medikamente einfordern dürfen, die zum Teil als Mondpreise bezeichnet werden können. Dieser gesamtgesellschaftlichen Herausforderung und Verantwortung wird sich die Politik kurzfristig stellen müssen.






 Gesunde Lebenswelten – Ein Angebot der Ersatzkassen
Gesunde Lebenswelten – Ein Angebot der Ersatzkassen Landesbasisfallwerte 2026
Landesbasisfallwerte 2026 ICF – Internationale Klassifikation der Funktionsfähigkeit, Behinderung und Gesundheit
ICF – Internationale Klassifikation der Funktionsfähigkeit, Behinderung und Gesundheit Beitragsbemessungsgrenzen und Beitragssätze 2026
Beitragsbemessungsgrenzen und Beitragssätze 2026 Heilmittelversorgung – Verträge und Vergütungen
Heilmittelversorgung – Verträge und Vergütungen


