Am 13. Dezember 2021 nahm das Europäische Parlament im Plenum die Verordnung zur Bewertung von Gesundheitstechnologien an. Sie zielt darauf ab, die Zusammenarbeit auf EU-Ebene bei der Bewertung von neuen Arzneimitteln und Medizinprodukten zu verbessern.

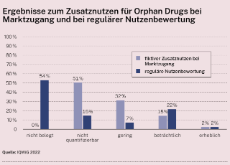
Die Verordnung wird schrittweise in Kraft treten. Zuerst fallen Krebsmedikamente ab Januar 2025 in den Anwendungsbereich der Bewertung. Neuartige Therapien und Arzneimittel für seltene Leiden (Orphan Drugs) werden im Januar 2028 folgen. Alle zentral zugelassenen Produkte werden im Januar 2030 bewertet.
Die Europäische Kommission hatte im Februar 2018 ihren Vorschlag für einen Rahmen für die Bewertung von Gesundheitstechnologien (Health Technology Assessment, HTA) auf EU-Ebene vorgelegt, um Überschneidungen zwischen den nationalen Verfahren zur Bewertung von Gesundheitstechnologien zu vermeiden, die Anforderungen an die Datenübermittlung durch die Hersteller zu harmonisieren und die europäische Zusammenarbeit im Bereich HTA nachhaltig zu unterstützen. Nach jahrelangen Verhandlungen wurde die Rechtsvorschrift am 13. Dezember formell angenommen, als das Europäische Parlament den Text billigte.
Der Rahmen sieht eine HTA-Zusammenarbeit auf EU-Ebene in vier Säulen vor:
- Im Rahmen der ersten Säule, der gemeinsamen klinischen Bewertung, wird der klinische Mehrwert einer Gesundheitstechnologie (zentral zugelassene Arzneimittel oder Medizinprodukte mit hohem Risiko und In-vitro-Diagnostika) bewertet. Das Ergebnis ist für die Mitgliedstaaten nicht bindend, sie müssen es lediglich bei der klinischen Bewertung von Gesundheitstechnologien auf nationaler Ebene „gebührend berücksichtigen“.
- Die zweite Säule umfasst die gemeinsame wissenschaftliche Konsultation, bei der die Unternehmen von der Koordinierungsgruppe Ratschläge zu ihren Plänen für die Entwicklung von Arzneimitteln erhalten.
- Die dritte Säule der Zusammenarbeit ist die Identifizierung neuer Gesundheitstechnologien, die erhebliche Auswirkungen auf die Gesundheitssysteme, Krankheiten oder Patienten haben würden.
- Die vierte Säule ist die freiwillige Zusammenarbeit bei nicht-klinischen Aspekten der HTA-Zusammenarbeit oder bei Technologien, die nicht in den obligatorischen Bereich der Zusammenarbeit fallen.
Ein Netz von Interessengruppen, dem Organisationen angehören, die Kostenträger, Patienten oder Angehörige der Gesundheitsberufe vertreten, wird die Beteiligung der Interessengruppen an der Funktionsweise des Rahmens sicherstellen.












 Gesunde Lebenswelten – Ein Angebot der Ersatzkassen
Gesunde Lebenswelten – Ein Angebot der Ersatzkassen Landesbasisfallwerte 2026
Landesbasisfallwerte 2026 ICF – Internationale Klassifikation der Funktionsfähigkeit, Behinderung und Gesundheit
ICF – Internationale Klassifikation der Funktionsfähigkeit, Behinderung und Gesundheit Beitragsbemessungsgrenzen und Beitragssätze 2026
Beitragsbemessungsgrenzen und Beitragssätze 2026 Heilmittelversorgung – Verträge und Vergütungen
Heilmittelversorgung – Verträge und Vergütungen


