Arzneimittel gegen seltene Krankheiten (Orphan Drugs) sollten bei Markteintritt dasselbe Nutzenbewertungsverfahren durchlaufen wie alle anderen Wirkstoffe. Dies zeigt eine aktuelle Auswertung des Instituts für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG).
Orphan Drugs genießen in der frühen Nutzenbewertung nach dem Arzneimittelmarktneuordnungsgesetz (AMNOG) ein Privileg: Um die Entwicklung solcher Arzneimittel gegen seltene Krankheiten trotz marktwirtschaftlicher Risiken zu fördern, unterliegen sie nicht dem regulären Nutzenbewertungsverfahren (mit Vergleich zur bisherigen Standardtherapie). Vielmehr wird für Orphan Drugs bereits mit Zulassung und Markteintritt ein Zusatznutzen als belegt angenommen – was zuweilen als „fiktiver“ Zusatznutzen bezeichnet wird. Der Gemeinsame Bundesausschuss (G-BA) kann den Zusatznutzen lediglich anhand der vom Hersteller vorgelegten Unterlagen quantifizieren. Selbst wenn keine Einordnung in die Kategorien „gering“, „beträchtlich“ oder „erheblich“ möglich ist, muss er dem Wirkstoff noch einen „nicht quantifizierbaren“ Zusatznutzen attestieren. Erst wenn mit dem Wirkstoff ein Jahresumsatz von mehr als 50 Millionen Euro erzielt wird, erfolgt eine reguläre Nutzenbewertung durch IQWiG und G-BA.
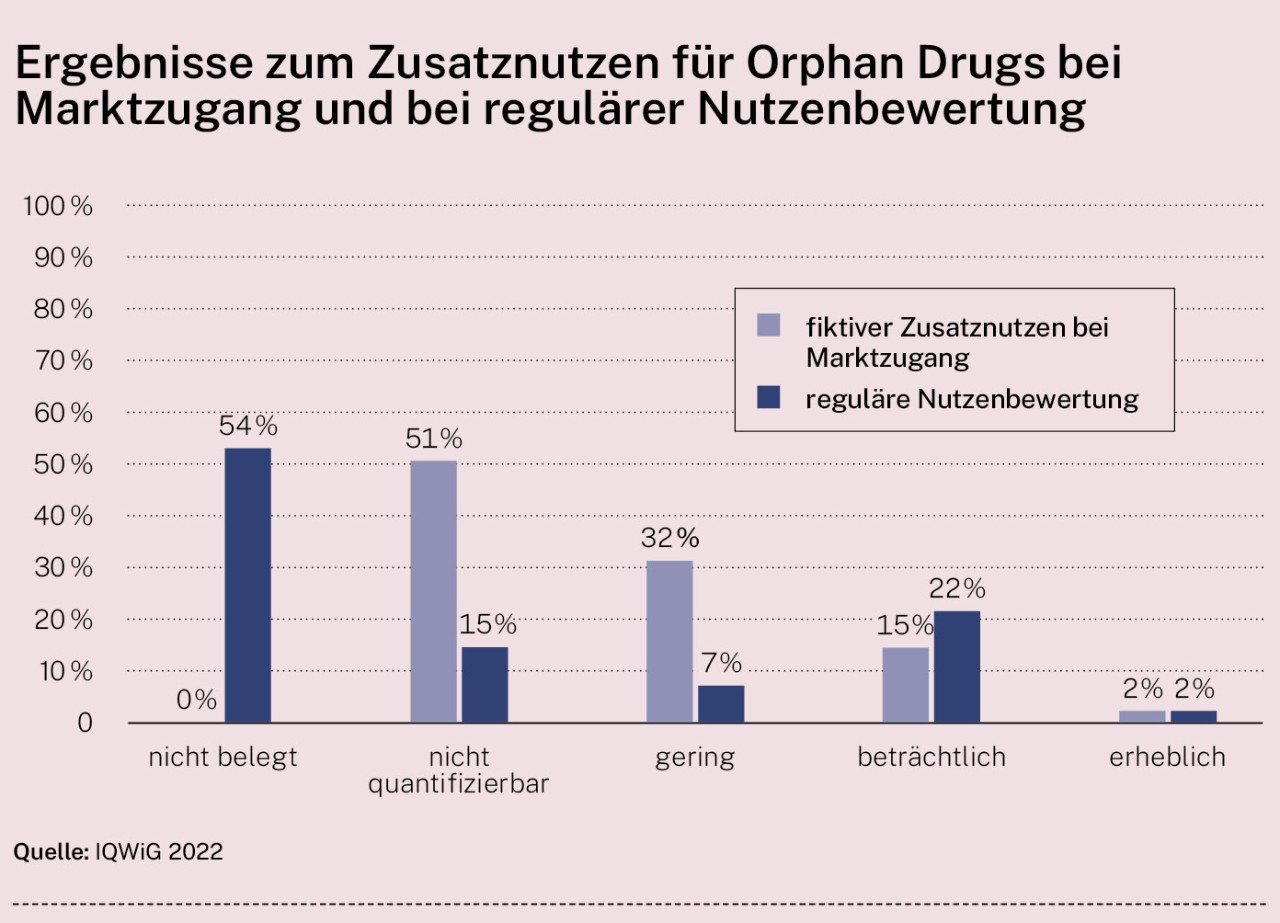
Das IQWiG hat nun ausgewertet, ob diese Bevorzugung von Arzneimitteln gegen seltene Leiden angemessen ist: Für alle Orphan Drugs, die seit Inkrafttreten des AMNOG im Jahr 2011 ein reguläres Nutzenbewertungsverfahren durchlaufen haben, wertete das Institut aus, ob der ursprünglich angenommene „fiktive“ Zusatznutzen nach der regulären Nutzenbewertung noch Bestand hatte. Ergebnis: Die Feststellung des Zusatznutzens bei Marktzugang wurde in mehr als der Hälfte der Fälle später nicht bestätigt. Das heißt, dem neuen Präparat war bei Markteintritt ein Zusatznutzen attestiert worden, obwohl später nicht belegt werden konnte, dass es den Patientinnen und Patienten tatsächlich Vorteile im Vergleich zur bisherigen Standardtherapie bringt.
Orphan Drugs haben häufig keinen Zusatznutzen
Für seine Analyse hat das IQWiG 41 Orphan-Drug- Bewertungen identifiziert, für die seit 2011 sowohl eine eingeschränkte Nutzenbewertung als auch nachfolgend eine reguläre Nutzenbewertung erfolgte. Diese 41 Bewertungen verteilen sich auf 20 verschiedene Wirkstoffe, da einige dieser Präparate für mehrere Anwendungsgebiete zugelassen wurden.
Die Auswertung zeigt, dass bei 22 der 41 Bewertungen (54 Prozent) in der regulären Nutzenbewertung kein Zusatznutzen („nicht belegt“) festgestellt wurde. In den eingeschränkten Bewertungen bei Marktzugang wurde hingegen, den gesetzlichen Vorgaben folgend, bei allen 41 Bewertungen ein Zusatznutzen konstatiert. Dabei war hier in mehr als der Hälfte der Fälle (21 Bewertungen, 51 Prozent) der Zusatznutzen „nicht quantifizierbar“.
Dabei wird die Einstufung des Zusatznutzens in der Regel erst nach Jahren korrigiert: Bei den 22 Fragestellungen ohne Nachweis eines Zusatznutzens lag der Zeitraum zwischen der eingeschränkten und der regulären Nutzenbewertung im Mittel bei gut drei Jahren (mindestens ein Jahr und bis zu neun Jahre). Teilweise wird die Einstufung des Zusatznutzens jedoch auch gar nicht korrigiert. Dies ist der Fall, wenn für das Orphan- Medikament die Umsatzschwelle von 50 Millionen Euro nicht überschritten und eine reguläre Nutzenbewertung daher nicht durchgeführt wird.
Die Spreu wird nicht vom Weizen getrennt
Wenn neue Arzneimittel ohne Datengrundlage bevorzugt gegenüber möglicherweise langjährig bewährten Alternativen eingesetzt werden, so hat das erhebliche Folgen für die Versorgung der Patientinnen und Patienten. Die Betroffenen und ihre Angehörigen haben dann in einer meist schwierigen Lebenssituation viel Hoffnung in ein neues Medikament gesetzt, für das erst Jahre später klar wird, dass es gar keinen Nachweis einer Überlegenheit gegenüber den vorhandenen Therapieoptionen gibt.
Darüber hinaus verhindert der generelle „fiktive“ Zusatznutzen, dass zwischen Orphan Drugs mit und ohne echten Fortschritt für die Patientenversorgung unterschieden werden kann. Ein wesentliches Ziel des AMNOG, nämlich die Spreu vom Weizen zu trennen, wird so bei den Orphan Drugs nicht erreicht.
Festzuhalten bleibt: Wenn in mehr als der Hälfte der Fälle, in denen eine reguläre Nutzenbewertung zu Orphan Drugs durchgeführt wurde, der ursprünglich konstatierte Zusatznutzen nicht bestätigt wird und Orphan Drugs, die einen echten Mehrwert darstellen, nicht mehr von Beginn an als solche erkannt werden können, besteht Handlungsbedarf: Zehn Jahre nach Inkrafttreten des Gesetzes zur frühen Nutzenbewertung setzt sich das IQWiG deshalb dafür ein, das Privileg des Zusatznutzens für Orphan Drugs abzuschaffen. Auch Arzneimittel gegen seltene Leiden sollten bei Markteintritt eine reguläre Nutzenbewertung gegenüber der zweckmäßigen Vergleichstherapie durch IQWiG und G-BA durchlaufen.
DAK: Kosten für Orphan Drugs haben sich verfünffacht
Die Fehlsteuerung bei den Orphan Drugs hat nicht nur Auswirkungen auf die Patientenversorgung, sondern auch auf die Arzneimittelausgaben der Krankenkassen. So vermeldete die DAK-Gesundheit kürzlich bei Vorstellung des AMNOG-Reports, dass sich die Kosten für neu zugelassene Orphan Drugs seit 2011 verfünffacht haben und im Jahr 2020 im Durchschnitt bei 540.000 Euro pro Jahr und Patient lagen. Für Arzneimittel mit einem echten Fortschritt für die Patientenversorgung mögen solche Preise berechtigt sein – für jene ohne Zusatznutzen gegenüber der zweckmäßigen Vergleichstherapie aber sicher nicht. Es ist unser aller Ziel, die Beiträge der Versicherten möglichst effektiv einzusetzen.












 Gesunde Lebenswelten – Ein Angebot der Ersatzkassen
Gesunde Lebenswelten – Ein Angebot der Ersatzkassen Landesbasisfallwerte 2026
Landesbasisfallwerte 2026 ICF – Internationale Klassifikation der Funktionsfähigkeit, Behinderung und Gesundheit
ICF – Internationale Klassifikation der Funktionsfähigkeit, Behinderung und Gesundheit Beitragsbemessungsgrenzen und Beitragssätze 2026
Beitragsbemessungsgrenzen und Beitragssätze 2026 Heilmittelversorgung – Verträge und Vergütungen
Heilmittelversorgung – Verträge und Vergütungen


